
隨著6月1日修改后《專利法》的生效,備受矚目的專利鏈接制度,即藥品專利糾紛早期解決機制(“早期解決機制”)在我國正式實施。本文將對該制度實施后對藥企所產生的影響進行初步的簡要分析,并探索一些影響實操的考量。
本文內容重點提示:
•從新藥獲批到仿制藥申請的最短間隔:0天
•從仿制藥申請到獲批的可能時長:10.5個月
•從新藥獲批到帶量采購的可能時長:22.5個月
•醫藥產品專利訴訟可能趨勢:“一品多訴"及"一品長訴”
作者| 徐鋒 王榮霞 張曉飛
本文首發于知產鏈接公眾號,轉載請注明出處
一、 “早期解決機制”的介紹
1. 背景
2017年5月12日,原國家食品藥品監督管理總局發布關于征求《關于鼓勵藥品醫療器械創新保護創新者權益的相關政策(征求意見稿)》意見的公告,提出要建立藥品專利鏈接制度、上市藥品目錄集。
2017年10月8日,中共中央辦公廳、國務院辦公廳發布《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(“42號文”),提出建立上市藥品目錄集、探索建立藥品專利鏈接制度、開展藥品專利期限補償制度試點、完善和落實藥品試驗數據保護制度。
2023年7月3日,全國人大常委會法制工作委員會發布了《專利法修正案(草案二次審議稿)》,增加了藥品專利糾紛早期解決機制條款。
2. 與“早期解決機制”相關的辦法和措施
為配合“早期解決機制”的實施,相關部門陸續出臺了配套辦法。
2023年9月11日,國家藥監局、國家知識產權局發布《藥品專利糾紛早期解決機制實施辦法(試行)(征求意見稿)》。該實施辦法就中國上市藥品專利信息登記平臺、仿制藥申請人做出的專利聲明、專利權人或者利害關系人對專利聲明有異議時提起訴訟或行政裁決、等待期、藥監部門的分類審批、首仿藥市場獨占期等內容進行了規定,提供了“早期解決機制”的具體流程和辦法。
2023年10月29日,最高人民法院發布《關于審理涉藥品上市審評審批專利民事案件適用法律若干問題的規定(征求意見稿)》。就涉藥品上市審評審批的專利訴訟相關的管轄、受理、證據、中止、保全、送達等法律問題進行了規定。
2023年2月9日,國家知識產權局發布《藥品專利糾紛早期解決機制行政裁決辦法(征求意見稿)》。就藥品上市審評審批過程中的專利糾紛行政裁決的請求主體、裁決范圍、行政裁決與訴訟的協調、裁決程序、裁決與無效的關系及裁決的執行和公開等進行了規定。
以上三個文件,從法院、藥監局和知識產權局三方面,制定了“早期解決機制”實施所需的配套辦法,但尚有概念需要界定(例如“首個挑戰專利成功且首個獲批上市的化學仿制藥品”需要具體滿足哪些條件),尚待更具體的操作辦法出臺。
3. “早期解決機制”的幾個基本要素:
3.1 中國上市藥品專利信息登記平臺(“專利登記平臺”)
申報藥品上市的申請人或藥品上市許可持有人要在“專利登記平臺”上登記藥品相關的專利信息,該信息將是仿制藥申請人作出專利聲明的基礎。目前允許被登記的化學藥和生物藥的專利類型包括:化學藥品活性成分化合物專利、化學藥品含活性成分的藥物組合專利、化學藥品醫藥用途專利;生物制品活性成分的序列結構專利、生物制品醫藥用途專利。
3.2四類專利聲明
仿制藥申請人提交上市申請時,應對被仿制藥每一件相關的藥品專利作出聲明。聲明分為四類:一類聲明是 “專利登記平臺”中沒有被仿制藥品相關專利信息;二類聲明是“專利登記平臺”的相關專利已終止或被宣告無效;三類聲明是“專利登記平臺”收錄有相關專利,仿制藥申請人承諾在專利期屆滿前暫不上市;四類聲明是“專利登記平臺”收錄的相關專利權應被無效,或者仿制藥未落入專利保護范圍。
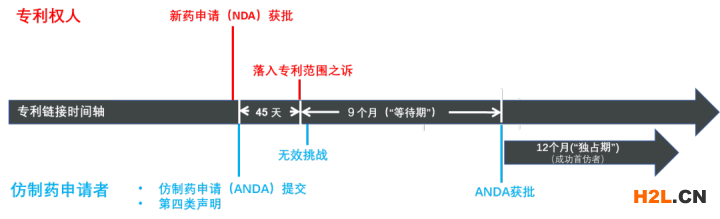
一旦仿制藥申請人做出第四類聲明,專利權人或利害關系人有異議的,可自國家藥品審評機構公示藥品上市許可申請之日起45日內就申請上市的藥品是否落入專利范圍起訴或申請行政裁決。
3.3 等待期
自人民法院或者國務院專利行政部門立案或者受理之日起,國務院藥品監督管理部門對化學仿制藥注冊申請設置9個月的等待期,等待期內國家藥品審評機構不停止技術審評。
如果9個月內收到法院判決或行政裁決,將作出相應處理:i)確認落入專利權保護范圍的,待專利權期限屆滿前20個工作日將化學仿制藥申請轉入行政審批環節;ii)確認不落入專利權保護范圍或雙方和解的,或者專利權被宣告無效的,將化學仿制藥申請轉入行政審批環節。
如果9個月內未作出生效判決或者行政裁決,或者未出具調解書的,將化學仿制藥申請轉入行政審批環節;如在行政審批期間收到人民法院判決或者國務院專利行政部門行政裁決,確認落入相關專利權保護范圍的,相關化學仿制藥申請將待專利權期限屆滿前20個工作日轉入行政審批環節。
3.4 獨占期
對首個挑戰專利成功且首個獲批上市的化學仿制藥品,給予市場獨占期,國務院藥品監督管理部門在該藥品獲批之日起12個月內不再批準同品種仿制藥上市,市場獨占期不超過被挑戰藥品的專利權期限。上述能夠獲得市場獨占期的“首個挑戰專利成功且首個獲批上市的化學仿制藥品”,并未明確“挑戰專利成功”除了指獲得專利無效的決定外(極可能的解釋),是否還包括獲得了確認不落入專利保護范圍的行政裁決或生效判決,以及該專利無效是否需要以提出仿制藥申請為前提,因而存在多個仿制藥同時成為“首仿藥“的可能性。
例如,三家仿制藥申請人,同時分別獲得了專利無效決定、確認不落入專利保護范圍的行政裁決或判決,并在同一(或很接近)時間段內獲批,那么將可能同時獲得“首仿”資格。而且,如果一份專利無效決定是同時對多個無效請求人做出的,那么,該多個無效請求人也有可能同時獲得“首仿”資格。
現有“早期解決機制”的有關化學藥品的一些特點及相關要素可用如下示意圖來簡單總結:
二、現有專利鏈接系統對醫藥市場的潛在影響
作為現有專利鏈接系統中的“早期解決機制”的實施,對制藥行業會產生重大影響,具體就目前中國醫藥市場而言,有三個時間節點值得關注,并可能催生大量專利無效及訴訟。
1. 從新藥獲批到仿制藥申請的最短間隔:0天
同最早源于美國HATCH-WAXMAN法案(1984年)的專利鏈接制度不同,目前的專利鏈接系統沒有類似“藥品試驗數據保護期”規定。
藥品試驗數據保護類制度是指在新藥上市后的一定期限內,藥品行政管理部門不允許仿制藥公司將原研藥的安全性和有效性等各類試驗數據用于仿制藥的上市申請。在不同國家與地區,這段期限長短不一(從4至8年甚至更長不等),設置、考量及機制不同,且名稱各異,如數據獨占期 (Data Exclusivity)、PMM (Post-marketing Monitoring)、PMS (Post-marketing Surveillance)等,不一而足。這類制度在實操上可以產生共同的效果:研究、收集、分析新藥上市后的病患使用安全數據從而及時發現、警示甚至撤回有安全隱患的藥品;讓新藥開發者有數年的市場獨占期,鼓勵原研研究的重大高風險投入,并激勵藥企在即使沒有專利保護的情況下也能繼續投資臨床實驗,讓新的藥品(或新的適應癥)上市。
醫藥創新高度發達的國家及地區一般都實施了藥品試驗數據保護類制度,如美國從小分子新藥獲批到仿制藥可以提交ANDA申請的時間間隔至少為4年;日本及歐盟近30個國家的這段時間設置至少為8年。此外,其它國家也有類似制度,如新加坡(5年)、新西蘭(5 年)、韓國(6年)、加拿大(6年)等。當然也有少數沒有這類制度的國家,例如印度、南非、巴西、菲律賓、印度尼西亞、委內瑞拉等。我國的《藥品管理法實施條例》有監測期和藥品試驗數據保護的相關規定,但其實施還需假以時日。而2018年出臺的《藥品試驗數據保護實施辦法(征求意見稿)》至今尚未確定。
藥品試驗數據保護類制度雖然貌似同專利鏈接制度無關,如歐盟有較長的數據強保護期(至少8年)而沒有專利鏈接制度,但極少有專利鏈接制度是缺失了與之配套的藥品試驗數據保護類制度的。這是因為,只要設置專利鏈接制度的目的包括“鼓勵新藥研究”,藥品試驗數據保護類制度就不能長期缺席,它是提高、推動醫藥創新的必要條件及重要“活性成份”。
由于新專利法下的專利鏈接制度目前主要是 “早期解決機制”,暫時沒有設置藥品試驗數據保護類制度,從NDA獲批到ANDA申請提交之間的時間在法律上是“零間隔”,這是新藥商業化安排中必須關注的一個時間點。
2. 從仿制藥申請到獲批:10.5個月
另一個對新藥商業化安排很重要的時間點是從仿制藥申請(ANDA)到獲批在“早期解決機制”框架下的可能時長。
至少對于某些化藥而言,如果“早期解決機制”結果為專利被無效(做出無效決定的時長通常為5-6個月)或不落入專利范圍,則根據異議啟動期(45天)及等待期(9個月)的設置可以推算得出,理論上在新藥上市后10.5個月(甚至更早)仿制藥可通過審批進入市場。而在我國,原研藥相關專利無效率相對較高¹,新藥上市后不久(甚至上市前)仿制藥就開始進行積極準備的情況非常普遍,所以一款小分子新藥上市不到一年即有仿藥獲批的可能性是存在的。
3. 從新藥獲批到帶量采購:22.5個月
目前“早期解決機制”對“首個挑戰專利成功且首個獲批上市的化學仿制藥品”提供12個月的獨占期,即在成功首仿之后12個月后(或距新藥上市后約22.5個月時),第二款仿制藥就可以進入市場。按照目前藥品集中采購的相關政策和規定,新藥及兩款已獲批的仿制藥既已符合納入帶量采購的條件。
值得指出的,“早期解決機制”中“等待期”的適用范圍僅限于化學藥,對生物藥而言,未設置等待期,這是對生物藥相關時間節點進行分析時需要考慮到的。
現實世界紛繁復雜,有許多因素(如產品自身、相關專利、市場、競爭格局等)都會影響上面的三個時間基點。藥品上市前后企業對商業化方案進行分析時,通常會考慮包括一些邊界條件(包括類似時間點)在內的因素,當然針對具體產品,其時間基點會在具體規劃中以不同的方式體現出來。
作為一個例子,2018年9月在我國上市的樂伐替尼,近期其晶型和制劑專利相繼被無效(其化合物專利將于2023年10月過期),目前已有多家企業申報仿制藥。將這些信息置于目前的專利鏈接系統中進行分析并做些時間平移(如假設樂伐替尼于2023年6月1日上市,化合物專利約三年后到期),不難得出樂伐替尼的三個可能的相關時間點。
4. “一品多訴”及“一品長訴”
“早期解決機制”下有些藥品可能會產生多起專利訴訟(“一品多訴”)、而且訴訟時長也不僅僅會限于九個月內(“一品長訴”),而可能延至相關仿制藥上市之后數月甚至數年。
按照目前的設計機制,除非仿制藥申請人做出的是第一至三類專利聲明,仿制藥申請就會觸發相應的法律事件。例如確認申請的藥物是否落入專利權保護范圍的訴訟或行政裁決,以及專利無效宣告請求及后續的行政訴訟。每個藥品有數件相關專利,而每件專利可以導致分別的確認是否落入保護范圍的行政裁決或訴訟,及無效程序和行政訴訟。如該藥品有3件專利,就可能產生6件乃至更多訴訟的“一品多訴”情形。這將導致專利訴訟數量的激增。
此外,首仿藥所能夠獲得的12個月的市場獨占期,也會激勵仿制藥公司積極提出仿制申請,而這將進一步增加專利訴訟量。
“專利登記平臺”所要求登記的專利種類對化學藥而言目前包括對應的化合物專利、化學藥品組合物專利以及化學藥品的用途專利;對生物藥而言,專利登記的種類僅限于序列結構專利和制藥用途專利,并不包括組合物和制劑專利。
由于化學藥的晶形專利、生物藥制劑等專利沒有被列入專利登記的范圍,從而缺乏通過“早期解決機制”在仿制藥上市前解決專利糾紛的機會。這些都會導致在仿制藥獲批前專利糾紛并未實質解決而需在其上市后繼續通過訴訟來解決的“一品長訴”情形。
三、總結與期待
綜上,本文對“早期解決機制”的背景和主要內容進行了介紹,并簡要分析了現有專利鏈接制度中三個值得關注的時間點,以及現有機制下可能存在“一品多訴”及“一品長訴”的狀況。
“早期解決機制”的建立和實施,標志著我國具有專利鏈接制度的藥品專利保護1.0時代的開啟。當前我國本土藥物創新潛力巨大,國產創新藥趕超全球研發進度,多個藥物獲得FDA認證,許可引進及轉讓藥品等均實現大爆發,國際化合作日益頻繁,生物科技領域投融資熱度空前²。醫藥企業研發活躍,猶如百舸爭流,專利鏈接的實施必將助力醫藥創新的快速和高質量發展。相信隨著機制的不斷運行和完善,同時具有藥品試驗數據保護和專利鏈接制度的藥品專利保護2.0時代也會隨之來臨,并更大程度地促進我國藥品創新、造福人民健康。
¹ (1)過去3年38款原研藥在華遭遇專利無效挑戰:55%全部無效,新藥前沿,2023年4月26日(“2017-2023年,跨國藥企的38款原研藥物在中國被提起專利權無效請求,已作出的審查決定中全部無效33件(占55%),部分無效20件(占33%),維持有效7件(占12%)”);(2)淺談國內醫藥創新知識產權保護的困境與破局,羅菊華,2023年7月23日(“在我們統計的2017-2023年審結的106件生物醫藥領域專利(不完全統計,不含中藥專利)中,被全部無效的專利比例高達54%,全部無效加部分無效的專利占69%”);(3)2023年近20款跨國藥企原研藥遭專利無效挑戰,全部無效超半數;新藥前沿,2023年5月18日(“在2023年,大約18款跨國藥企原研藥品相關的24件專利遭遇中國制藥企業或個人提出專利挑戰,涉及國家知識產權局作出的26項決定號,全部無效決定占54%。”);(4)《中美經貿協議》后我國藥品專利無效數據分析,許波等,醫藥知識產權案例觀察,2023年5月29日(“自《中美經貿協議》生效以來,針對藥品專利的全部無效率為37%,部分無效率為31%,維持有效率為32%”)。
² https://www.sohu.com/a/468932000_115207;2021中國健康產業白皮書:醫藥與生物科技篇
中企檢測認證網提供iso體系認證機構查詢,檢驗檢測、認證認可、資質資格、計量校準、知識產權貫標一站式行業企業服務平臺。中企檢測認證網為檢測行業相關檢驗、檢測、認證、計量、校準機構,儀器設備、耗材、配件、試劑、標準品供應商,法規咨詢、標準服務、實驗室軟件提供商提供包括品牌宣傳、產品展示、技術交流、新品推薦等全方位推廣服務。這個問題就給大家解答到這里了,如還需要了解更多專業性問題可以撥打中企檢測認證網在線客服13550333441。為您提供全面檢測、認證、商標、專利、知識產權、版權法律法規知識資訊,包括商標注冊、食品檢測、第三方檢測機構、網絡信息技術檢測、環境檢測、管理體系認證、服務體系認證、產品認證、版權登記、專利申請、知識產權、檢測法、認證標準等信息,中企檢測認證網為檢測認證商標專利從業者提供多種檢測、認證、知識產權、版權、商標、專利的轉讓代理查詢法律法規,咨詢輔導等知識。
本文內容整合網站:百度百科、搜狗百科、360百科、知乎、市場監督總局 、國家知識產權局
免責聲明:本文部分內容根據網絡信息整理,文章版權歸原作者所有。向原作者致敬!發布旨在積善利他,如涉及作品內容、版權和其它問題,請跟我們聯系刪除并致歉!








