在美國(guó),一個(gè)普通的新化合物從最初的發(fā)現(xiàn)到申請(qǐng)上市,大約需要經(jīng)過(guò)15年的時(shí)間,其中FDA用于審評(píng)的時(shí)間大約為6~10個(gè)月。
美國(guó)新藥審評(píng)是在FDCA(Federal Food, Drug and Cosmetic Act,聯(lián)邦食品、藥品、化妝品法案)中規(guī)定的。盡管FDCA被許多人看來(lái)在這類法律中是最復(fù)雜的一個(gè),但此法案有關(guān)新藥審評(píng)最重要的條款卻相當(dāng)簡(jiǎn)單。首先,F(xiàn)DCA規(guī)定:用于診斷、治愈、緩解、預(yù)防人、其它動(dòng)物疾病的物品;用于影響人、或其它動(dòng)物身體的結(jié)構(gòu)、或功能的物品(食品除外)為藥品。FDCA還規(guī)定,任何新藥在上市之前一定要表明它是安全、有效的以及經(jīng)過(guò)審批。
新藥申請(qǐng)條件
符合以下情況均可向FDA提出NDA 申請(qǐng):
1. 新分子實(shí)體 (NME)
2. 新化學(xué)實(shí)體(NCE)
3. 原批準(zhǔn)藥品相同化學(xué)成分的新鹽基、新酯基
4. 原批準(zhǔn)藥品的新配方組成
5. 原批準(zhǔn)藥品的新適應(yīng)癥(包括處方藥轉(zhuǎn)非處方藥使用)
6. 新劑型、新給藥途徑、新規(guī)格(單位含量)
7. 兩種以上原批準(zhǔn)藥品的新組合
新藥注冊(cè)途徑

505(b)——《聯(lián)邦食品、藥品、化妝品法案》第5章第505分章,即505法案。
505法案包括NDA的3種申請(qǐng):
第一種: 505b1 :申報(bào)者進(jìn)行所有藥學(xué)研究(Completely new)
第二種: 505b2:同樣也是申報(bào)者進(jìn)行所有藥學(xué)研究,但不同的是部分信息不實(shí)由申報(bào)者自己完成(by),或者這些研究不是為了申報(bào)者而完成的(for);以及申報(bào)者沒(méi)有引用的權(quán)利(Hybrid new, Some studyyou can bridge)
第三種:505j:欲申報(bào)制劑在API,劑型,給藥途徑,標(biāo)簽,質(zhì)量,檢驗(yàn),適應(yīng)癥上都和已有品種一樣。(Generic, ANDA)
505j是ANDA的申請(qǐng)途徑,本文中就不做詳談。
新藥申請(qǐng)程序
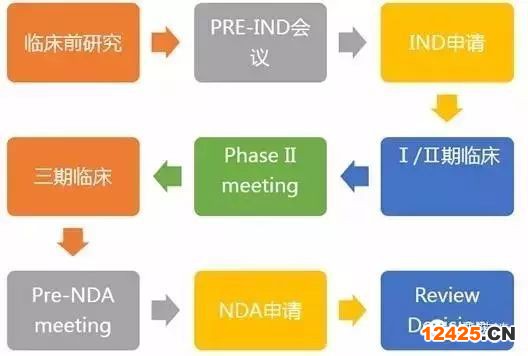
美國(guó)每年上市許多新藥,雖品種不同,F(xiàn)DA對(duì)它們的評(píng)審要求也各不相同,但評(píng)審框架還是一致的,大體可分為以下幾步:
1臨床前研究
新藥安全、有效性的研究最終將在人體上進(jìn)行,但在FDA允許試驗(yàn)藥物試用于人體之前,必須證明該藥的研究對(duì)人體是安全的。如果藥品申辦者不能從現(xiàn)有的研究數(shù)據(jù)、本國(guó)及他國(guó)的使用等數(shù)據(jù)證明該藥是安全的,那么就必須要進(jìn)行臨床前研究。在這階段,F(xiàn)DA一般規(guī)定(最低限度)藥品申辦者必須:(1)做該藥的藥理研究;(2)在至少二種動(dòng)物身上進(jìn)行急毒試驗(yàn);(3)按照該藥預(yù)想的用途進(jìn)行為期二個(gè)星期至三個(gè)月的短期研究;
需要指出的是,一旦臨床前研究結(jié)束,動(dòng)物試驗(yàn)并沒(méi)有結(jié)束隨之完成,許多時(shí)間更長(zhǎng)、更專項(xiàng)的研究如慢性、抗癌試驗(yàn)將在整個(gè)新藥申請(qǐng)過(guò)程中進(jìn)行。
臨床前研究用來(lái)評(píng)估:
藥品的藥理學(xué)現(xiàn)象和作用機(jī)理(MOA)
藥物毒性特征和毒性靶器官
藥物吸收、分布、代謝和排泄(ADME)
2提出新藥臨床試驗(yàn)申請(qǐng)(IND)
當(dāng)藥品申辦者認(rèn)為它已具有足夠的數(shù)據(jù)證明該藥是安全時(shí),就可準(zhǔn)備向FDA提交新藥臨床研究申請(qǐng)(IND)。本質(zhì)上IND只是一個(gè)建議,通過(guò)這個(gè)建議,藥品申辦者獲得FDA的許可,開(kāi)始在人身上進(jìn)行試驗(yàn)。
在臨床研究申請(qǐng)中,藥品申辦者必須提交至少以下兩個(gè)領(lǐng)域的材料。首先,它必須向FDA公布所有臨床前研究的結(jié)果,提供該藥組成的信息,以及生產(chǎn)該藥的生產(chǎn)、質(zhì)控程序。其次,它還必須提供臨床研究的計(jì)劃書。在計(jì)劃書中詳細(xì)敘述了藥品申辦者希望的臨床研究以證明該藥用于人體的安全性、有效性。還有和臨床研究有關(guān)的一些其它材料包括研究者(臨床醫(yī)生)的資格也必須包括在內(nèi)。

按照現(xiàn)行規(guī)定,F(xiàn)DA有30天的時(shí)間來(lái)決定是否允許該藥進(jìn)行人體試驗(yàn),同時(shí)FDA還將評(píng)價(jià)臨床計(jì)劃書。臨床研究計(jì)劃要保證臨床受試者不應(yīng)受到不必要的危險(xiǎn)以及有希望證明該藥用于人體是安全、有效的。
如果在提交IND以后30天內(nèi),F(xiàn)DA沒(méi)有同藥品申辦者聯(lián)系,那么臨床試驗(yàn)就可以開(kāi)始。然而,藥品申辦者在開(kāi)始臨床研究之前最好還是同F(xiàn)DA取得聯(lián)系。
一旦FDA作出決定臨床研究不應(yīng)開(kāi)始,它應(yīng)在30天內(nèi)發(fā)出,推遲臨床試驗(yàn)直到相關(guān)問(wèn)題得到解決。一般來(lái)說(shuō),F(xiàn)DA發(fā)出“臨床試驗(yàn)暫停”通知,主要是以下幾個(gè)原因:
(1) 臨床前研究未能證明該藥用于人體會(huì)是安全的;
(2) 臨床前研究未符合GLP及一些其它標(biāo)準(zhǔn);
(3) 所建議的臨床研究計(jì)劃書不完整、臨床研究不安全;
如果申請(qǐng)人在申請(qǐng)IND后的兩年內(nèi)都沒(méi)有按計(jì)劃進(jìn)行臨床研究,或該IND的臨床試驗(yàn)被中止叫停超過(guò)一年,F(xiàn)DA便會(huì)將此 IND列為“失活狀態(tài)”(Inactive Status)。一旦IND被置于“失活狀態(tài)”,所有臨床研究者都必須被通知到,并按照21CFR 312.30的要求將臨床研究用藥品退還給申請(qǐng)人或立即銷毀。
IND分為以下兩個(gè)類別:
①商業(yè)性IND(Commercial IND)
商業(yè)性IND是指為申請(qǐng)新藥上市目的而申請(qǐng)開(kāi)展的全新臨床試驗(yàn)。IND的申請(qǐng)人通常與企業(yè)進(jìn)行合作。商業(yè)性IND里面有一種情況叫作“探索性IND”(Exploratory IND)或“篩查性IND”(Screening IND),作為遞交的第一個(gè)申報(bào)文件以支持對(duì)新藥開(kāi)展最早的1期臨床研究。
②非商業(yè)性IND(Non-Commercial IND)
非商業(yè)性IND是由醫(yī)生自行開(kāi)展的研究,該研究旨在研究藥品對(duì)特定人群的療效或?yàn)闊o(wú)藥可治的患者提供未經(jīng)批準(zhǔn)的藥物治療。非商業(yè)性IND包括有研究性IND(InvestigatorIND/Research IND)。
IND申報(bào)文件包主要包括9部分的內(nèi)容:
①首頁(yè)函、FDA 1571表;②目錄;
③引言和總體研究計(jì)劃;
④研究員手冊(cè);
⑤臨床研究方案;
⑥化學(xué)、生產(chǎn)和質(zhì)量控制信息;
⑦藥理和毒理信息;
⑧已有人體臨床經(jīng)驗(yàn);
⑨額外信息;
在IND申報(bào)文件包中,還需提交相關(guān)原始完整研究報(bào)告,如,毒理研究報(bào)告等。
3臨床試驗(yàn)
如果FDA批準(zhǔn)IND申請(qǐng),臨床試驗(yàn)(由人類受試者參與的研究)可以開(kāi)始。
1期臨床:嚴(yán)格控制藥物在少量的健康志愿者身上進(jìn)行,大約有20—80例。這階段的試驗(yàn)主要是獲得藥物的基本的安全性數(shù)據(jù)、以及藥理信息。受試者一般為健康志愿者。
2期臨床:試驗(yàn)藥物在一小部分受試者身上進(jìn)行,大約為100到200例。這些病人是患有該藥物預(yù)設(shè)所治的疾病。這個(gè)階段進(jìn)一步提供了該藥的安全性數(shù)據(jù),用于建議用途的第一個(gè)適應(yīng)癥使用該試驗(yàn)藥的有效性。如果藥品申辦者能夠從該藥的使用、或之前的臨床研究得出結(jié)果該藥用于臨床是安全的話,一期臨床甚至某些情況下的二期臨床可以省去。
3期臨床:參與受試者有數(shù)百人到數(shù)千人,重點(diǎn)考察藥物的安全性和有效性。試驗(yàn)藥物在較多的受試者之間進(jìn)行,這些受試者患有該藥物預(yù)設(shè)所治、診斷、預(yù)防等的疾病。在開(kāi)始本階段研究之前,藥品申辦者必須向FDA提交從一、二期臨床試驗(yàn)中的數(shù)據(jù)以表明該藥是有理由安全、有效的以及具有有利的效益/風(fēng)險(xiǎn)比。
End of Phase IIA meeting(EOP2A)
在II期臨床試驗(yàn)完成以后,F(xiàn)DA強(qiáng)烈建議申請(qǐng)人在開(kāi)始III期關(guān)鍵性臨床試驗(yàn)之前,提出EOP2會(huì)議。
EOP2A會(huì)議發(fā)生在臨床試驗(yàn)獲得在擬定適應(yīng)癥中的劑量反應(yīng)關(guān)系后,包括劑量范圍對(duì)安全性、生物標(biāo)志物和概念性驗(yàn)證的影響;通常發(fā)生在I期臨床試驗(yàn)完成和第一批患者暴露-反應(yīng)試驗(yàn)之后和IIb期(如患者劑量范圍試驗(yàn))和III期臨床有效性安全性試驗(yàn)之前
EOP2A有助于幫助申請(qǐng)人找到最佳劑量,節(jié)約成本,將后期臨床試驗(yàn)的成功率最大化。
為了能夠充分利用EOP2會(huì)議與FDA進(jìn)行溝通,在會(huì)議開(kāi)始一個(gè)月之前,申請(qǐng)人應(yīng)向FDA提交一個(gè)會(huì)議文件包:
1.會(huì)議請(qǐng)求& 會(huì)議信息(60天): Y or N
2.日期、時(shí)間和參會(huì)者
3.總結(jié)所有更新的數(shù)據(jù) (臨床, CMC, 藥理/毒理等)
4.提出 Phase III 開(kāi)發(fā)計(jì)劃
5.提出可能使用的藥物標(biāo)簽
6.問(wèn)答
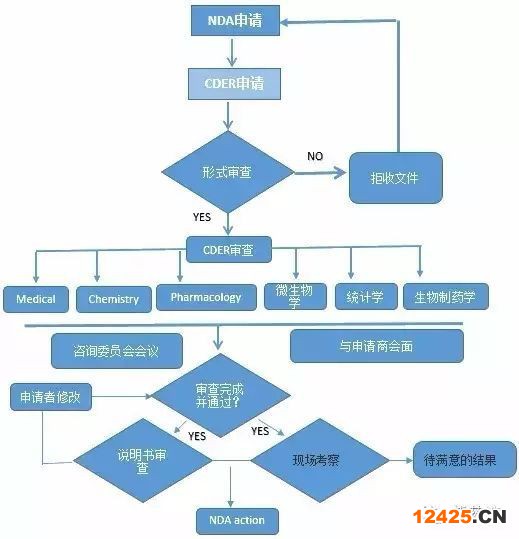
4新藥申請(qǐng) (NDA)
臨床試驗(yàn)結(jié)束之后,藥物申請(qǐng)者可提交一份 NDA,申請(qǐng)批準(zhǔn)這款藥物在美國(guó)銷售。FDA根據(jù)藥品的治療特性,在審查程序上分為“標(biāo)準(zhǔn)審查(Standard Review,SR)”和“優(yōu)先審查(Priority Review,PR)”兩類。對(duì)“能夠在治療、診斷或疾病預(yù)防上比已上市藥品有顯著改進(jìn)的新藥”,F(xiàn)DA 對(duì)非常重要的 NDAs 在 6個(gè)月內(nèi)進(jìn)行審評(píng),新藥的標(biāo)準(zhǔn)審評(píng)時(shí)間是 10 個(gè)月。FDA根據(jù)《政策和程序手冊(cè)》(Manual of Policies and Procedures,MAPPs)相關(guān)規(guī)定可采取“優(yōu)先審查”(Priority Review),評(píng)審時(shí)間由標(biāo)準(zhǔn)審查的10個(gè)月縮短為6個(gè)月。
NDA評(píng)審是最嚴(yán)格、耗時(shí)的過(guò)程,而且只有很小比例的試驗(yàn)藥最終能允許進(jìn)入了市場(chǎng)。
此外,F(xiàn)DA還通過(guò)快速通道(FastTrack)來(lái)鼓勵(lì)藥物創(chuàng)新和加快審查用于治療嚴(yán)重或威脅生命疾病或尚未滿足臨床治療需求的新藥,例如艾滋病、阿爾茲海默病、心衰、腫瘤、癲癇、抑郁癥和糖尿病等。一旦符合快速通道(Fast Track)的藥品,F(xiàn)DA必須在60天內(nèi)做出決策。
新藥上市后的監(jiān)測(cè)
藥物被批準(zhǔn)之后,藥品的標(biāo)簽可能進(jìn)行變更,內(nèi)容包括藥物副作用的新信息。藥物申請(qǐng)者需要提交安全性變更,醫(yī)生或患者也可以向 FDA報(bào)告有關(guān)藥物的嚴(yán)重不良事件。引起更嚴(yán)重、超出預(yù)期副作用的藥物在必要的情況下要從市場(chǎng)撤市。
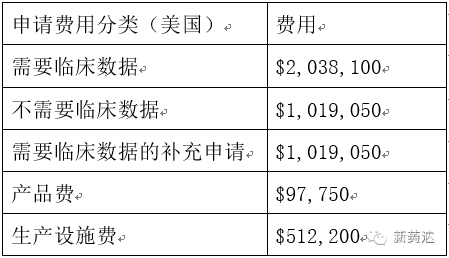
NDA申請(qǐng)費(fèi)用——PDUFA
PDUFA即《處方藥申報(bào)者付費(fèi)法案》,F(xiàn)DA依據(jù)該法案向制藥商/申報(bào)者收取一定的審查費(fèi)用。
PDUFA費(fèi)用主要包括三部分:1、申請(qǐng)費(fèi) 2、生產(chǎn)設(shè)施費(fèi) 3、產(chǎn)品費(fèi)
法案同時(shí)也規(guī)定,PDUFA費(fèi)用只針對(duì)新藥申請(qǐng)階段(NDA)收取有關(guān)費(fèi)用,而對(duì)于臨床前研究(Pre-IND)申報(bào)資料的審評(píng),是不收取有關(guān)費(fèi)用的。
費(fèi)用的免除、削減和退還
PDUFA條款中也指出,當(dāng)免除費(fèi)用的決定有助于公眾健康和安全、費(fèi)用收取會(huì)給藥品創(chuàng)新帶來(lái)障礙、或者所收費(fèi)用超過(guò)審查成本時(shí),F(xiàn)DA可做出免除、削減或退還收費(fèi)的決定。
中企檢測(cè)認(rèn)證網(wǎng)提供iso體系認(rèn)證機(jī)構(gòu)查詢,檢驗(yàn)檢測(cè)、認(rèn)證認(rèn)可、資質(zhì)資格、計(jì)量校準(zhǔn)、知識(shí)產(chǎn)權(quán)貫標(biāo)一站式行業(yè)企業(yè)服務(wù)平臺(tái)。中企檢測(cè)認(rèn)證網(wǎng)為檢測(cè)行業(yè)相關(guān)檢驗(yàn)、檢測(cè)、認(rèn)證、計(jì)量、校準(zhǔn)機(jī)構(gòu),儀器設(shè)備、耗材、配件、試劑、標(biāo)準(zhǔn)品供應(yīng)商,法規(guī)咨詢、標(biāo)準(zhǔn)服務(wù)、實(shí)驗(yàn)室軟件提供商提供包括品牌宣傳、產(chǎn)品展示、技術(shù)交流、新品推薦等全方位推廣服務(wù)。這個(gè)問(wèn)題就給大家解答到這里了,如還需要了解更多專業(yè)性問(wèn)題可以撥打中企檢測(cè)認(rèn)證網(wǎng)在線客服13550333441。為您提供全面檢測(cè)、認(rèn)證、商標(biāo)、專利、知識(shí)產(chǎn)權(quán)、版權(quán)法律法規(guī)知識(shí)資訊,包括商標(biāo)注冊(cè)、食品檢測(cè)、第三方檢測(cè)機(jī)構(gòu)、網(wǎng)絡(luò)信息技術(shù)檢測(cè)、環(huán)境檢測(cè)、管理體系認(rèn)證、服務(wù)體系認(rèn)證、產(chǎn)品認(rèn)證、版權(quán)登記、專利申請(qǐng)、知識(shí)產(chǎn)權(quán)、檢測(cè)法、認(rèn)證標(biāo)準(zhǔn)等信息,中企檢測(cè)認(rèn)證網(wǎng)為檢測(cè)認(rèn)證商標(biāo)專利從業(yè)者提供多種檢測(cè)、認(rèn)證、知識(shí)產(chǎn)權(quán)、版權(quán)、商標(biāo)、專利的轉(zhuǎn)讓代理查詢法律法規(guī),咨詢輔導(dǎo)等知識(shí)。
本文內(nèi)容整合網(wǎng)站:百度百科、搜狗百科、360百科、知乎、市場(chǎng)監(jiān)督總局 、國(guó)家認(rèn)證認(rèn)可監(jiān)督管理委員會(huì)、質(zhì)量認(rèn)證中心
免責(zé)聲明:本文部分內(nèi)容根據(jù)網(wǎng)絡(luò)信息整理,文章版權(quán)歸原作者所有。向原作者致敬!發(fā)布旨在積善利他,如涉及作品內(nèi)容、版權(quán)和其它問(wèn)題,請(qǐng)跟我們聯(lián)系刪除并致歉!
本文來(lái)源: http://m.rumin8raps.com/zs/202303/ccaa_47187.html